В 2018 году внутренний рынок Китая показал значительный спрос на товары со всего мира. Эта реакция на проводимые в последнее время реформы связанные с открытостью страны. С ростом внутреннего фармацевтического рынка, импорт лекарственных препаратов и медицинских изделий в Китае продолжает увеличиваться высокими темпами. Следует отметить, что темпы роста импорта лекарственных средств и API в последнее время выше, чем темпы экспорта.

В 2017 году импорт активных фармацевтических ингредиентов (API) в Китай достиг 8,723 млрд. долл. США, что на 14,3% больше, чем за 2016 год, и является абсолютным максимумом за весь предыдущий период.. Основа импорта Китая в этой сфере: сырье для препаратов сердечно-сосудистой системы (кальций аторвастатин, каптоприл, валсартан и т.д.), витамины (витамин Е, витамин В12 и т.д.), сырье класса цефалоспорина (цефтриоксон, цефаклор и т.д.), сырье для противоопухолевых препаратов (капецитабин, циклофосфамид и т.д.), для противовирусных лекарственных средств (энтекавир, тенофовир и т. д.) и многие другие.
Фактически, хоть Китай и может производить почти все виды API, из-за низкого качества сырья и ненадлежащего контроля производственных процессов, транснациональные фармацевтические компании склонны выбирать сырьевые фармацевтические предприятия, принадлежащие или сотрудничающие с зарубежными компаниями для контроля качества и защиты патентов. Сырье поставляется на фармацевтическую производственную базу в Китае для переработки в готовые фармацевтические продукты или премиксы, а затем продается на китайском рынке в виде готовых форм либо реэкспортируется в виде премиксов. Это также привело к тому, что 72% импортных API в Китае были переработаны предприятиями, финансируемыми из-за рубежа, из которых на долю иностранных инвестиций приходилось 53% от общего импорта, среди них Pfizer, Roche, Bayer, Squibb, AstraZeneca, Novartis и т.д.
Тенденция роста количества предприятий,
импортирующих сырье в Китай за последние 5 лет
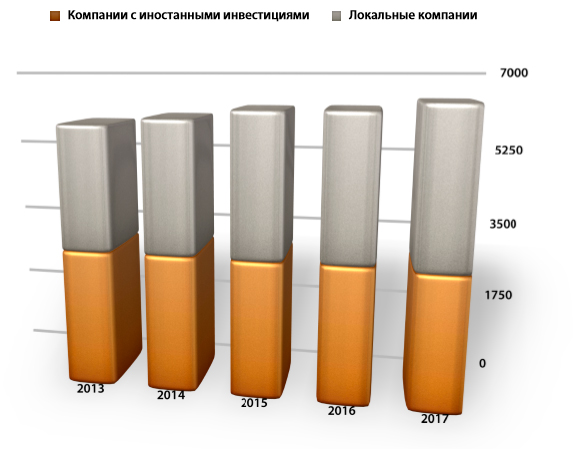
Фармацевтические компании занимают лидирующие позиции в бизнесе импорта сырья в Китае. Странами-импортерами в основном являются Ирландия, Япония, США, Германия и Франция. Продукция этих пяти стран вместе составляют более половины импорта API в Китай.
Кроме того, в последнее время многие местные компании начинают импортировать сырье. Одни используют импортное сырье в производстве фармацевтических продуктов для внутреннего рынка (например Yangzijiang Pharmaceutical), другие продают переработанные продукты за рубежом самостоятельно (например Keyuan Xinhai) или через импортных торговых агентов (например ProLogo).
В настоящее время существует 6 469 предприятий, занимающихся импортном сырья и его переработкой, из которых 3432 являются местными предприятиями, причем их количество увеличилось на 628 за последние пять лет, что составило более 20%. Причина в основном заключается в том, что вырос внутренний спрос на API. Это привело к появлению бизнес-возможностей для импорта активных фармацевтических ингредиентов и способствовали непрерывному расширению импорта API в Китай.
Оценка соответствия не патентованных лекарств единым стандартам подтолкнула спрос на высококачественное фармацевтическое сырье.
С момента запуска системы оценки соответствия дженериков в Китае отдел регулирования лекарственных средств выпустил ряд документов для директивных указаний и требует, чтобы в конце 2018 года в принципе был завершен процесс стандартизации производственных процессов для 289 готовых твердых препаратов, и в 2018 году была проведена оценка таких же процедур для производства инъекционных препаратов.
Несомненно, что кристаллическая форма, чистота, оптическое вращение и спектр примесей лекарственного вещества будут влиять на результаты оценки качество общего лекарственного средства. Существуют некоторые различия между стандартами качества лекарственного вещества в Китае и лекарственным веществом, используемым в оригинальном лекарственном препарате.

Кроме того, уровень технологии производства некоторых высококачественных API и фармацевтических вспомогательных веществ в Китае является низким, что приводит к тому, что некоторые сырьевые материалы не соответствуют оригинальным компонентам для не патентованных лекарств, таких как полноценный витамин D3, микрокристаллическая целлюлоза и др.
Оценка импортного сырья должна помочь производителям высококачественных импортных API и фармацевтических эксципиентов выйти на китайский рынок, а также заставит китайских API-производителей и тщательным образом относиться к исследованиям и разработкам с целью улучшения качества продукции, добиться её полного соответствия международным стандартам.
Реализация системы DMF снизила порог использования импортных API.
23 ноября 2017 года Государственное управление по контролю за продуктами и лекарствами выдало «Уведомление об экспертизе и одобрении лекарственных средств на основе сырья, фармацевтических вспомогательных веществ и фармацевтических упаковочных материалов (№ 146 от 2017 года)» и начало осуществлять контроль за производством субстанций и фармацевтических вспомогательных веществ в соответствии с этим документом.

В соответствии с этим документом, существенно изменена система регистрации лекарственных препаратов - она стала быстрее и значительно проще, поскольку большая часть информации содержится в соответствующих разделах DMF активных компонентов лекарств, уменьшено количество предоставляемых материалов для регистрации (только базовая информация, контроль качества, стабильность и т. д.) Был изменен способ предоставления материалов - теперь достаточно передавать их в электронном виде. Таким образом скорость регистрации сократилась с нескольких месяцев до пяти рабочих дней(!!!), что значительно сократило институциональный порог для использования импортных API. Теперь производители лекарств могут не только выбирать локальных производителей API, у которых есть регистрация, но и зарубежных производителей API, которые могут получить регистрационный номер, в соответствии с этим регламентом.
Таможенное оформление API стандартизировано, а процедуры проверки еще более упрощены.
В апреле 2018 года Государственное управление по лекарственным средствам выпустило «Объявление по соответствующим вопросам, касающимся ввозной таможенной очистки фармацевтического сырья (№ 8 от 2018 года)» и «Уведомление о соответствующих вопросах, касающихся импортной таможенной инспекции импортируемых химических веществ (№12 от 2018 года). Эти документы изданы с целью определить порядок импорта и таможенной очистки сырья и фармацевтических наполнителей и упростить процедуры таможенного досмотра в отношении импорта химического сырья и препаратов.

С одной стороны, согласно заявлению № 146 от 2017 года, было уточнено содержание документов для одобрения импортированных API, а с другой стороны, импортная таможенная очистка для импортированных API была упрощена. В частности была отменена обязательная проверка в порту при импорте сырья.
Льготы при импорте противоракового сырья и снижение налогов будут способствуют для внутреннего фармацевтического рынка Китая.
28 апреля 2018 года Министерство финансов и соответствующие министерства и комиссии официально опубликовали «Уведомление о политике НДС для противораковых лекарств» с целью корректировки налога на добавленную стоимость на импортные противораковые препараты. В уведомлении разъясняется, что с 1 мая 2018 года налог на добавленную стоимость будет взиматься с импортных противораковых препаратов на 3%. Перечисленный список содержит 51 разновидность противоопухолевых лекарственных препаратов, обычно используемых в отечественных препаратах.
Вскоре после введения политики нулевого тарифа для импортируемых противораковых лекарств государство сократило налог на добавленную стоимость на импорт противораковых лекарств, нацеленный на снижение конечных цен на лекарства. Для импортируемого противоракового сырья сокращение налога на добавленную стоимость способствует поощрению его участия в конкуренции на рынке отечественного рынка лекарств, косвенно содействуя улучшению качества и ценовой конкуренции на рынке противораковых препаратов Китая.
Проблемы, связанные с загрязнением окружающей среды, заставляет многих производителей API в Китае перепрофилировать свои производства.
Из-за затрат на охрану окружающей среды некоторые производители отказались от производства API и обратились к международному рынку за покупками API. В условиях монополизации сырья и дефицита предложения предприятиям, которые сосредоточены на экспорте препаратов, приходится отказаться от поставок сырья в Китае, чтобы сохранить долю на рынке, и выбрать импорт сырья из-за рубежа для переработки, а затем реэкспорта. Экологическое давление и нестабильное предложение привели к тому, что некоторые из API стали импортировать, что косвенно способствовало расширению импорта Китая API.
Все эти меры в значительной степени способствуют развитию фармацевтического рынка Китая и направлены на ликвидацию дефицита на нем лекарственных препаратов и повышения качества лекарственных средств, представленных на нем.

